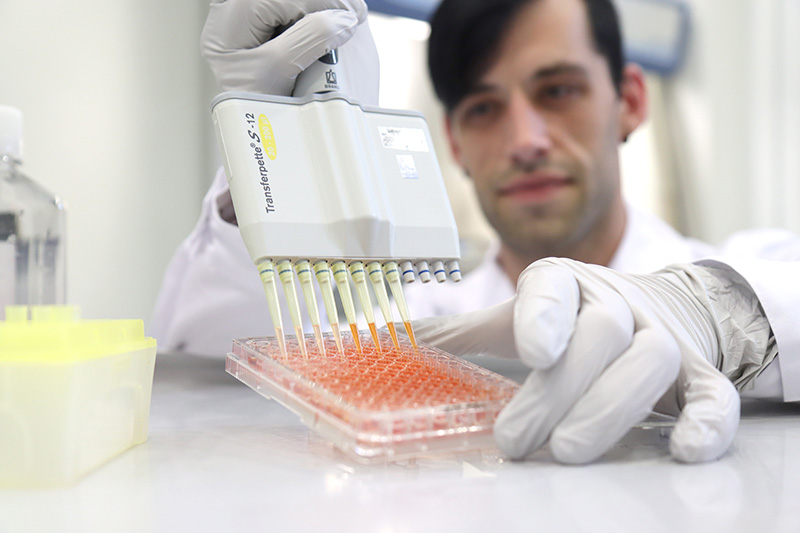
Dr. Thomas Dauben, Leiter des Biologielabors der OMPG in Rudolstadt, während einer Prüfung auf Zytotoxizität. Die unterschiedliche Färbung auf der Mikrotiterplatte zeigt an, ob es den Zellen gut geht. Bei eher blasser Farbe sind sie durch Schadstoffe in ihrer Vitalität eingeschränkt. (Bildrechte: OMPG / Steffen Beikirch)
Dass hier gerade viel in Bewegung gerät, spürt man auch bei der OMPG in Rudolstadt. Das Testlabor bietet die biologische Prüfung von Medizinprodukten an, ist hierfür von der Deutschen Akkreditierungsstelle (DAkkS) und der Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG) akkreditiert. „Diese Prüfungen dienen der Beurteilung der Biokompatibilität von Medizinprodukten und sind eine Voraussetzung für deren Zulassung“, sagt Laborleiter Dr. Thomas Dauben. Die MDR-Verordnung fordere diesen Nachweis für alle Materialien, mit denen Patienten, medizinisches Personal oder andere Anwender in Kontakt kommen können.
Zur Beurteilung der Biokompatibilität werden drei Testverfahren angewandt: die Prüfung auf Zytotoxizität, Hautirritation und Sensibilisierung. „Meist fragen die Hersteller alle drei Prüfungen bei uns im Paket an“, berichtet Dauben. Am häufigsten beauftragen Kunden der OMPG jedoch die Zytotoxizitätsprüfung nach DIN EN ISO 10993-5. „Dies ist der erste und wichtigste Test im Rahmen der Biokompatibilitätsbewertung von Medizinprodukten. Erst, wenn sich hier Probleme andeuten, lohnt es sich, mit den anderen beiden deutlich aufwändigeren Untersuchungen in die Tiefe zu gehen“, so der Laborleiter.
Bei der Prüfung auf Zytotoxizität wird das Medizinprodukt mit einem Extraktionsmedium versetzt, um potenziell schädliche Stoffe herauszulösen. Der Extrakt wird in verschiedenen Verdünnungen auf lebende Zellen aufgebracht. Nach einer bestimmten Inkubationszeit unter detailliert vorgegebenen Bedingungen werden die Zellen dann mittels einer biochemischen Reaktion darauf untersucht, ob sie durch schädliche Substanzen in ihrem Wachstum oder in ihrer Vitalität eingeschränkt worden sind.
Während diese Prüfung schon immer zellbasiert durchgeführt wurde, finden die beiden weiterführenden Tests in der Regel in Verbindung mit Tierversuchen statt. Nicht so bei der OMPG: Das Rudolstädter Labor verwendet für die Prüfung auf Hautirritation eine Methode mit dreidimensionalen humanen Hautmodellen. Für die Untersuchung auf Sensibilisierung durch allergenes Potenzial etabliert die OMPG derzeit ebenfalls tierversuchsfreie Methoden, die bald zur Verfügung stehen sollen.
Unterdessen wurde für den Test auf Zytotoxizität jetzt erstmals ein externer Ringversuch angeboten, an dem sich die OMPG beteiligte. „In der Vergangenheit mussten sich Labore hier selbst um Vergleichsprüfungen mit anderen Dienstleistern bemühen“, sagt Dauben. Daher sei der erstmals vom Johner Institut (Konstanz) veranstaltete Ringversuch mit 18 Laboren, einer externen Aufgabenstellung und einer unabhängigen externen Bewertung deutlich höher einzustufen. „Die OMPG hat den Ringversuch erfolgreich bestanden. Dieses Ergebnis ist sehr wichtig für unsere Qualitätssicherung und bestätigt, dass unsere Prozesse stabil laufen und dabei verlässliche, reproduzierbare Resultate garantieren“, so Dauben.